OBJETIVO
Determinacion cuantitativa de hormona tiroidea TSH.
FUNDAMENTO
Se basa en la detección de la hormona TSH (que actúa como antígeno) mediante la unión a un anticuerpo anti-TSH sensibilizado en una placa de microtitulacion y posterior revelado mediante la adición de un segundo anticuerpo anti-TSH pero conjugado con un cromógeno (complejo enzima-sustrato) y cuantificación en función de la cantidad de color detectada por el lector de placas (por espectrofotometría).
MATERIALES
- Papel de filtro
- Vaso de precipitado
- Micropipeta
- Puntas de Micropipeta
- Placa de microtitulacion (96 pocillos)
- Lector de placas
- Agua destilada
- Pocillos de ELISA para determinación de TSH
- Muestra: suero

Fuente: fotos tomadas por mi en el laboratorio de analisis clinico del IES albaida - Patrones:
- Patrón 1: 0 µUi/mL
- Patrón 2: 0.1 µUi/mL
- Patrón 3: 0.5 µUi/mL
- Patrón 4: 2 µUi/mL
- Patrón 5: 5 µUi/mL
- Patrón 6: 10 µUi/mL
Fuente: fotos tomadas por mi en el laboratorio de analisis clinico del IES albaida
- Reactivo:
- Anticuerpos anti-TSH conjugados con peroxidasa
- Sustrato TMB
- Solución de parada (solución stop)
Fuente: fotos tomadas por mi en el laboratorio de analisis clinico del IES albaida
PROCEDIMIENTO
- Colocar los pocillos que se van a utilizar sobre la placa de microtitulacion
- Depositar 100 µL de cada patrón y cada muestra en pocillos diferentes
- Añadir el anticuerpo anti-TSH conjugado
- Incubar a temperatura ambiente durante 2 horas
- Eliminar la muestra de los pocillos mediante 5 lavados añadiendo 200 µL de agua destilada y vaciando los pocillos bien entre un lavado y otro (sacudir si es necesario)

Fuente: fotos tomadas por mi en el laboratorio de analisis clinico del IES albaida - Añadir 100 µL de TMB y agitamos 5 segundos
- Se incuba a temperatura ambiente durante 20 minutos
- Se añade la solución de parada y se agita 30 segundos (debe cambiar el color a amarillo)
- Se lee en el lector de placas ajustado a 450 nm
RESULTADOS
Hacer una curva de calibración con las concentraciones de los patrones y las absorbancias obtenidas tras la realización de la técnica.
Las absorbancias de los patrones son:
- Patrón 1: 0
- Patrón 2: 0.105
- Patrón 3: eliminado el resultado por no cuadrar con lo que debería
- Patrón 4: 0.256
- Patrón 5: 0.466
- Patrón 6: 0.818
Esta es la gráfica resultante:
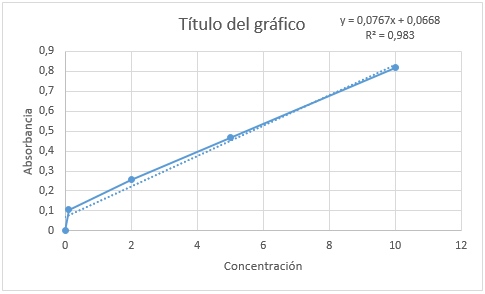
Para calcular las concentraciones de las muestras, debemos despejar la incognita correspondientes (X) en la formula obtenida en la gráfica.
En nuestro caso, las muestras son:
- Muestra 1: 0.161 (1.2 µUi/mL)
- Muestra 2: 0.157 (1.176 µUi/mL)
- Muestra 3: 0.148 (1.058 µUi/mL)
INTERPRETACIÓN
Los valores de referencia deben rondar entre:
- Normal: entre 0.07 y 1.84 µUi/mL
- Hipertiroidismo: <0.07 µUi/Ml
- Hipotiroidismo: >1.84 µUi/mL
Según esto, nuestros valores de todas las muestras se encuentran dentro de los valores normales.
PRECAUCIONES
- Respetar adecuadamente los tiempos para que los resultados sean lo mas precisos posibles.
- Cambiar las puntas de pipeta cada vez que se pipetea para evitar contaminaciones entre las distintas muestras y controles.
- Debemos introducir los valores adecuadamente en la gráfica de calibración.
- Tener cuidado al despejar la formula para calcular las concentraciones de las muestras a analizar.
- Todo debe estar adecuadamente etiquetado para evitar errores en la interpretación de los resultados por error en los pacientes a los que pertenece cada muestra.
BIBLIOGRAFÍA Y WEBGRAFÍA
IMÁGENES: las imágenes aportadas a en este PNT para su realización son realizadas por mi en el laboratorio del instituto I.E.S. Albaida.
INFORMACIÓN:
- Protocolo obtenido del profesorado del instituto I.E.S. Albaida
- Wikipedia: https://es.wikipedia.org/wiki/Wikipedia:Portada
- Blog de laboratorio clínico: http://laboratorioareaclinica.blogspot.com/search/label/Tinciones%20bacteriol%C3%B3gicas